Галогенопохідні вуглеводнів
Галогенопохідними вуглеводнями називають сполуки, які можна розглядати як продукти заміщення одного або декількох атомів водню в молекулі вуглеводню атомами галогенів. Прикладами сполук цього класу можуть служить хлороформ, чотирихлористий вуглець та інші речовини.
Фізичні властивості
Фізичні властивості залежать від вуглеводню, галогену та кількості атомів галогену.
Нижчі представники — гази або рідини, вищі — рідини або кристалічні речовини. Температура кипіння збільшується зі збільшенням довжини вулеводню та кількості атомів галогенів при однакових галогенах, та зі збільшенням атомної маси галогену при однакових вуглеводнях. Винятками є фторпохідні вуглеводнів, бо зі збільшенням кількості атомів фтору температура кипіння зменшується.
| Назва | Формула | Температура плавлення, °C | Температура кипіння, °C | Відносна густина |
|---|---|---|---|---|
| Фторметан | -141,8 | -78,6 | 0,877 (-79 °C) | |
| Хлорметан | -141,8 | -24,2 | 0,991 (-25 °C) | |
| Бромметан | -93,6 | 3,6 | 1,732 (0 °C) | |
| Йодметан | -66,1 | 42,5 | 2,279 (20 °C) | |
| Фторетан | -143,2 | -37,7 | 0,816 (-37 °C) | |
| Хлоретан | -138,7 | 12,2 | 0,921 (0 °C) | |
| Бромметан | -119 | 38,2 | 1,43 (20 °C) | |
| Йодетан | -108,5 | 72,2 | 1,993 (20 °C) | |
| 1-Хлорпропан | -122,8 | 47,2 | 0,892 (20 °C) | |
| 3-Хлорпропен | -136,4 | 44,6 | 0,938 (20 °C) | |
| 3-Хлорпропін | - | 65 | 1,045 (20 °C) | |
| Хлортолуол | -48,0 | 179,3 | 1,103 (20 °C) | |
| Дифторметан | - | -51,6 | - | |
| Дихлорметан | -96.7 | 40,1 | 1,326 (20 °C) | |
| Дийодметан | 5,0 | 180 | 3,325 (20 °C) | |
| Трифторметан | -163 | -82,2 | - | |
| Трихлорметан | 63,5 | 61,5 | 1,488 (20 °C) | |
| Трийодметан | 119 | 210 | 4,008 (20 °C) | |
| Тетрафторметан | -184 | -128 | 1,96 (-184 °C) | |
| Тетрахлорметан | -22,8 | 76,8 | 1,595 (20 °C) | |
| Хлоретилен
(Хлористий вініл) |
-153,8 | -13,8 | 0,973 (-15 °C) | |
| Брометилен | -137,8 | 15,8 | 1,5286 (11 °C) | |
| Трихлоретилен | -86,4 | 87,2 | 1,465 (20 °C) | |
| 2-хлорбута1,3-дієн | - | 59,4 | 0,9585 (20 °C) | |
| Хлорбензен | -45,6 | 131,7 | 1,1063 (20 °C) | |
| Бромбензен | -30,6 | 156 | 1,495 (20 °C) | |
| Йодбензен | -31,3 | 188,4 | 0,832 (20 °C) | |
| Орто-дихлорбензен | -17,5 | 182 | 1,305 (20 °C) | |
| Пара-дихлорбензен | 53 | 173 | 1,458 (20 °C) |
Часто мають солодкий запах.
Не розчиняються у воді, але розчиняються в органічних розчинниках. Деякі рідкі галогенпохідні вуглеводнів самі є розчинником для органічних сполук.
Хімічні властивості
В залежності від гібридизації атому вуглецю, з яким утворює зв'язок галоген, галогенпохідні вуглеводнів поділяють на: — галогеналкани (Hal-C(sp3)), наприклад, йодометан CH3I, галогеналкени (Hal-C(sp2)), наприклад, вінілхлорид CH2=CHCl, галогеналкіни (Hal-C(sp)), наприклад, йодацетилен HCCI — арилгалогеніди (Hal-C(ароматичний)), наприклад, хлорбензен, PhCl
Будова
Зв'язок C-Hal
Хімічні властивості сильно залежать від зв'язку вуглецю з галогеном.
Оскільки у галогенів та вуглецю різна електронегативність, цей зв'язок є полярним та схильним до гетеролітичного розриву. Усі зв'язки , окрім , є менш міцними, ніж .
На полярність зв'язку також впливає вуглеводневий радикал. Найбільш полярними є сполуки з аллінільною групою , далі йде .
| Зв'язок | Енергія зв'язку, кДж/моль | Довжина зв'язку, нм | Ковалентний радіус галогену, нм |
|---|---|---|---|
| 443 | 0,141 | 0,06 | |
| 328 | 0, 176 | 0,099 | |
| 279 | 0,191 | 0,114 | |
| 240 | 0,21 | 0,136 |
Найменш полярним та найбільш міцним є зв'язок через високу електронегативність атома вуглецю у sp-гібридізації.
Ізомерія
R, S-ізомерія
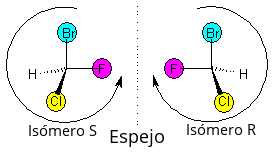
Якщо в галогенпохідному вуглеводні міститься один або більше хіральних атомів вуглецю, у цієї сполуки є оптичні ізомери.
Для позначення цих ізомерів використовують R, S-номенклатуру: спочатку треба зрозуміти, який замісник є старшим. Старшим вважається той замісник, у якого більший атомний номер елемента, з'єднаного з хіральним атомом. Якщо вони однакові, старшим вважається той, у кого більше атомний номер у другому, третьому шарі. Наприклад, старший за , бо в нього у другому шарі атом вуглецю. Якщо є подвійні зв'язки, то вважається, що там є ще один атом того елементу. Наприклад, вважається, що в групі є два атоми кисню.
Далі треба подивитися по осі зв'язку С-молодший замісник (зазвичай це зв'язок С-Н) з протилежного від молодшого замісника боку (тобто так, щоб атом вуглецю закривав замісник). Буде видно три замісники. Якщо вони стоять в порядку від старшого до молодшого за годинниковою стрілкою, то це R-ізомер, а якщо проти годинникової — S-ізомер.
Але може бути й так, що є декілька хіральних атомів вуглецю. Тоді у молекули є більше двох ізомерів. Наприклад, у 2,3-дибромпентана (два хіральних атома) є 4 ізомери: R,R; S, S; S, R; R, S. Пари R, R та S, S, а також R, S та S, R є оптичними антиподами. Інші пари (R, R та R, S, S, S та S, R та інші) не є антиподами. Вони є стереоізомерами, або діастереомерами. Діастереомери відрізняються фізичними, а інколи й хімічними, властивостями.
Ізомери галогенаренів
У галогенарену є ізомери, якщо там є два або більше атомів галогену. Якщо є два атоми галогену, вони можуть бути у трьох різних положеннях відносно одне одного: орто-, мета- та пара-положення. Якщо замісники прикріплені до двох сусідніх атомів вуглецю, то це — орто-ізомер, якщо між ними є один атом вуглецю — мета-, а якщо два — пара-. Такі ізомери можуть відрізнятися фізичними властивостями. Наприклад, температура плавлення орто-дихлорбензену -17,5 °С, а пара-дихлорбензену — 53 °С.

Реакції нуклеофільного заміщення
В результаті реакцій нуклеофільного заміщення нуклеофіл замінює галоген:
Щоб ця реакція відбувалася, потрібно, що аніон галогену був стабільніший за нуклеофіл. Стабільність аніонів збільшується зі збільшенням періоду галогену. Тому найбільш хімічно активними є йодпохідні вуглеводнів.
З атомом карбону у sp3-гібридізації
У реакції нуклеофільного заміщення вступають переважно галогенпохідні вуглеводнів, в яких атом вуглецю, з'єднаний з галогеном, знаходиться у sp3-гібридізації.
Вступають у реакцію із основами з утворенням спиртів:
Із сульфідами або сірководнем утворюють тіоли:
Найактивніші представники можуть взаємодіяти навіть із водою:
Взаємодіють з алкоголятами з утворенням простих ефірів:
Аналогічно утворюють тіоетери:
А при взаємодії з тіоетерами утворюють сульфонієві солі:
Із солями карбонових кислот утворюють естери:
Вступають у реакцію з аміаком з утворенням первинних амінів:
Далі ці первинні аміни вступають у реакцію з утворенням вторенних і третинних амінів та четвертинних амонієвих солей:
Потім ця суміш амінів взаємодіє з галогеноводневими кислотами, що утворилися, з утворенням солей:
Також утворюють нітросполуки:
Щоб отримати чистіші нітросполуки, використовують AgNO2, бо галогеніди срібла нерозчинні:
При взаємодії з ціанідом натрію утворюють органічні ціаніди:
Потім група може бути перетворена у карбонільну або аміногрупу:
З атомом вуглецю у sp2-гібридізації
Оскільки електронегативність атома вуглецю у sp2-гібридізації вища, ніж в sp3-гібридізації, зв'язок C-Hal є менш полярним та більш міцним. Через це галогенпохідні вуглеводнів з атомом вуглецю у sp2-гібридізації важче вступають у реакції нуклеофільного заміщення.
При звичайній температурі галогеналкени майже не вступають у ці реакції, а якщо їх нагріти — буде йти багато побічних реакцій.
Серед таких сполук реагують переважно галогенарени при температурі вище 200 °С з міддю та солями міді(I). При цьому ароматичне кільце залишається стабільним:
Можна використовувати солі міді(I) з потрібним аніоном:
Для отримання фенолу можна використати гідроксид натрію:
Реакції з металами
Галогенпохідні вуглеводнів реагують з магнієм:
Галогенпохідні вуглеводнів зі зв'язком C(sp2)-Hal реагують з магнієм тільки в розчині тетрагідрофурану.
Також реагують з натрієм з утворенням алканів:
Взаємодія з натрієм відбувається поетапно:
1. Спочатку атом натрію віддає електрон галогенпохідному вуглеводню, який потім може перейти до галогену:
2. Потім до цього радикалу приєднується інший атом натрію, утворюючи поляризовану натрійорганічну сполуку:
Далі ця поляризована сполука зустрічає нову молекулу галогенпохідного вуглеводню, теж поляризовану. Позитивний натрій з'єднується з негативним галогеном, а радикали, що залишилися, утворюють алкан:
Заміщення галогену воднем
Галогенпохідні вуглеводнів зі зв'язком C(sp3)-Hal можуть вступати у реакцію з йодоводневою кислотою із заміщенням атома галогену на атом водню:
Галогенпохідні вуглеводнів зі зв'язком C(sp2)-Hal у такі реакції, як і у реакції нуклеофільного заміщення, вступають важче.
Реакції дегідрогалогенізації
Реакції дегідрогалогенізації — це реакції, при яких від галогенпохідних вуглеводнів відривається одночасно атом галогену й атом водню.
Якщо галоген прикріплений до атома вуглецю з номером 1, то реакція може пройти у трьох варіантах: α-дегідрогенізація (відривається атом водню від першого атому вуглецю), β-дегідрогалогенізація (від другого), а також γ-дегідрогалогенізація (від третього).
При α-дегідрогалогенізації утворюється нестабільний карбен:
При β-дегідрогалогенізації утворюється алкен:
А при γ-дегідрогалогенізації утворюється цикл:
При α- та γ-дегідрогалогенізації утворюються нестабільні сполуки. Також третій атом вуглецю не такий активний, бо розташований далеко від галогену. Тому найбільш розповсюдженими є реакції β-дегідрогалогенізації.
Реакції протікають у спиртових розчинах лугів, бо галогеноводень, що вивільнюється, нейтралізує луг:
При дегідрогалогенізації дигалогеналканів утворюються галогеналкени:
Аналогічно з дигалогеналкенів утворюються галогеналкіни:
Галогеналкіни також можна отримати дегідрогалогенізацією тетрагалогеналканів:
Отримання
Пряме галогенування
Можна отримати галогенуванням алканів та аренів. Ця реакція підходить для отримання хлор- та бромпохідних вуглеводнів:
Для хлорування потрібна висока температура або ультрафіолетове випромінювання. Еквімолярна суміш хлору та алкану може вибухати, тому цю реакцію проводять з надлишком алкану. Для бромування потрібна і температура, і ультрафіолетове випромінювання. Бромування для метану та етану малохарактерно.
Але ці способи не дуже добрі, оскільки утворюється суміш моно-, ди-, полізаміщених похідних.
Для отримання фторпохідних вуглеводнів використовують фторування бром- та хлорпохідних за допомогою фториду срібла, кобальту або мангану:
Ця реакція йде дуже енергійно та з вибухом. В результаті цієї реакції утворюються перфторалкани.
Приєднання
Ще можна отримати галогенуванням алкенів та алкінів:
Такі реакції добре йдуть, якщо галоген — це хлор, бром або йод.
Можна отримати гідрогалогенуванням алкенів та алкінів:
Зазвичай розчин HF не дає добрих результатів. Це пов'язано з низькою нуклеофільністю іона CF2-, який утворюється у цих розчинах. Тому краще використовувати безводний фтороводень.
Заміщення
Також можна отримати галогенуванням альдегідів, кетонів, або карбонових кислот :
Найбільш розповсюджений лабораторний спосіб — заміщення гідроксильної групи на атом галогену:
Для отримання хлоралканів краще використовувати :
Ще можна отримати із солей карбонових кислот:
Галогенметилування
Щоб отримати галогенпохідні аренів з галогеном у боковому ланцюзі, арени можна галогенметилувати :
Ця реакція відбувається поетапно:
1. Спочатку утворюється гідроксиметил-катіон, спирт, який може з'єднатися з галогеном, утворюючи хлорметиловий спирт
2. Далі він з'єднується з ареном:
Інші методи
Ненасичені галогенпохідні вуглеводнів можна отримати за допомогою реакцій дегідрогалогенізації (див. Реакції дегідрогалогенізації).
Представники
Дихлорметан — CH2Cl2 рідина з температурою кипіння 40,1 °С. Застосовується як розчинник.
Хлороформ CHCl3 (або трихлорметан) — рідина, що кипить при 61,5 °C; застосовувалася для наркозу при хірургічних операціях.
Йодоформ CHI3 — кристалічна речовина жовного кольору, що плавиться при 119 °С. Має антисептичну дію.
Чотирихлористий вуглець CCl4 — важка негорюча рідина (темп. кип. 76,8 °C); застосовується як розчинник при витяганні жирів і масел з рослин; як важка рідина для фракційних аналізів мінеральної сировини тощо.
Дифтордихлорметан CF2Cl2 (фреон) — газ, що конденсується при мінус 29,8 °C. Фреон не отруйний, не реагує при звичайній температурі з металами; при випаровуванні його поглинається велика кількість тепла. Застосовується в холодильних машинах.
Тетрафторетилен — безбарвний газ. Його отримують за допомогою піролізу фреона-22 CHF2Cl. З нього отримують фторопласт.
Хлоретан CH3-CH2Cl — газ, що легко зріджується. У рідкому вигляді застосовується для анестезії. При інгаляційному введенні має наркотичну дію.
Хлористий вініл СН2=CHCl — похідна етилену. Безбарвний газ, що легко полімеризується в пластичну масу, так званий полівінілхлорид (—СН2 — CHCl—), дуже стійку до дії кислот і лугів.
Полівінілхлорид широко використовується для футерування труб і реакторів в хімічній промисловості. Він застосовується також для ізоляції електричних дротів, виготовлення штучної шкіри, лінолеуму, прозорих портативних плащів і т. д.
Хлоруванням полівінілхлориду одержують перхлорвінілову смолу, з якої виготовляють хімічно стійке волокно хлорин.
Література
- В. І. Саранчук, М. О. Ільяшов, В. В. Ошовський, В. С. Білецький. Хімія і фізика горючих копалин. — Донецьк: Східний видавничий дім, 2008. — с. 600. ISBN 978-966-317-024-4
- Кузнецов Д. Г. Органическая химия: Учебное пособие. — СПб.: Издательство «Лань», 2016. — 556 с. ISBN 978-5-8114-1913-5
- Глинка Н. Л. Общая химия. 24-е изд. — Л.: Химия, 1985. — 702с.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.