Формула Рідберґа
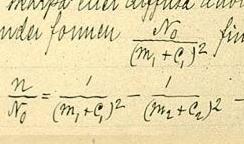
Фо́рмула Рідберґа — емпірична формула, яка описує довжини хвиль у спектрах випромінювання атомів хімічних елементів. Запропонована шведським вченим Йоганнесом Рідберґом і опублікована 5 листопада 1888 року.
Формула Рідберґа для водневоподібних елементів має такий вигляд:
де
- — довжина хвилі світла у вакуумі;
- — стала Рідберґа для хімічного елемента, що розглядається;
- — атомний номер, або число протонів у ядрі атома даного елемента;
- та — цілі числа, так що .
Історія
В 1880-х роках, Рідберґ працював над формулою, що описувала б взаємозв'язок між довжинами хвиль у спектрах лужних металів. Він помітив, що лінії утворюють серії і, що можна зменшити трудомісткість розрахунків, використовуючи хвильове число (величина, що обернена до довжини хвилі: 1/λ) як одиницю вимірювання. Він записав хвильові числа (n) розташованих одна за одною ліній в кожній серії навпроти розташованих паралельно у відповідному порядку цілих чисел, що являють собою порядок лінії в даній конкретній серії. Виявивши, що отримані криві мали схожі форми, він знайшов єдину функцію, яка описує всі ці криві, при підставці в неї відповідних констант.
Спочатку він перевірив формулу: , де n — це хвильове число лінії, n0 — границя серії, m — порядковий номер лінії в серії (константа, що є різною для різних серії) і C0 — універсальна константа. Ця формула не завжди давала задовільні результати.
Рідберґ перевірив: , коли йому стала відомою серія Бальмера для спектру атома водню . У цій формулі, m — ціле, і h — константа.
Рідберґ, однак, переписав формулу Бальмера, використовуючи позначення хвильових чисел, у такому вигляді .
Це навело на думку, що формула Бальмера для водню може бути частковим випадком при і , де , величина, обернена до константи Бальмера.
Величина Co, як виявилось, була універсальною константою, спільною для усіх елементів, рівною 4/h. Ця константа відома як стала Рідберґа, і m, відома як квантовий дефект.
Як підкреслив Нільс Бор[1], вираження результатів через хвильові числа, а не через довжини хвиль, було ключем до відкриття Рідберга. Фундаментальна роль хвильових чисел була особливо підкреслена відкриттям комбінаційного принципу Рідберґа — Ріца у 1908 році. Фундаментальна причина цього лежить в області квантової механіки.
Хвильові числа світлових хвиль є пропорційними до частоти , і тому також є пропорційними до енергії квантів світла E. Тобто, . Графіки Рідберґа були спрощеними (мали невисокий ступінь адекватності реальним залежностям), так як відбивали лише найпростіші закономірності у поведінці спектральних ліній в умовах строго визначених (квантованих) різниць енергій між електронними орбіталями в атомі.
Класичний вираз Рідберґа (від 1888 року) для форми спектральних серій не супроводжувався фізичним поясненням. Доквантове пояснення В. Ріца (1908 рік) механізму «утворення» спектральних серій полягало у тому, що електрони в атомі ведуть себе як магніти, що можуть коливатись відносно атомного ядра, генеруючи електромагнітне випромінювання.[2]. Цей феномен уперше зрозумів Нільс Бор у 1913 році і увів його у свою модель атома.
У теорії атома водню за Бором цілі числа Рідберґа (і Бальмера) n відповідають електронним орбіталям для різних строго визначених відстанях від атома. Частота (або спектральна енергія), отримана при переході з рівня n1 на n2, є енергією фотона, що випромінюється чи поглинається, при переході електрона з орбіталі 1 на орбіталь 2.
Формула Рідберґа для водню

де
- — довжина хвилі електромагнітного випромінювання у вакуумі;
- — стала Рідберґа;
- і — цілі числа, такі, що .
Взявши рівним 1, і вважаючи, що може набувати цілих значень від 2 до нескінченності, отримуємо спектральні лінії, відомі як серія Лаймана, нижня границя довжин хвиль яких прямує до 91 нм. Аналогічно можна отримати інші серії:
| n1 | n2 | Назва серії | Нижня границя серії |
|---|---|---|---|
| 1 | 2 → ∞ | Серія Лаймана | 91.13 нм (Ультрафіолетова частина спектру) |
| 2 | 3 → ∞ | Серія Бальмера | 364.51 нм (Видима частина спектру) |
| 3 | 4 → ∞ | Серія Пашена | 820.14 нм (Інфрачервона частина спектру) |
| 4 | 5 → ∞ | Серія Брекета | 1458.03 нм (Інфрачервона частина спектру) |
| 5 | 6 → ∞ | Серія Пфунда | 2278.17 нм (Інфрачервона частина спектру) |
| 6 | 7 → ∞ | Серія Гемпфрі | 3280.56 нм (Інфрачервона частина спектру) |
Формула Рідберґа для довільних водневоподібних атомів
Формула для атома водню, що наведена вище, може бути доповнена для застосування до довільних водневоподібних атомів:
де
- — довжина хвилі світла, що випромінюється у вакуум;
- — стала Рідберґа для даного хімічного елемента;
- — порядковий номер елемента в періодичній системі хімічних елементів, тобто, число протонів в атомному ядрі даного хімічного елемента;
- і — цілі числа, такі, що .
Важливо зазначити, що ця формула може бути застосована лише для водневоподібних атомів, тобто для таких атомів, які містять в електронній оболонці лише один електрон. До таких атомів відносяться, наприклад, He+, Li2+, Be3+ тощо.
Формула Рідберґа дозволяє отримати коректні значення довжин хвиль для віддалених електронів, коли ефективний заряд ядра можна вважати таким же як і у водню, коли всі, окрім одного, заряди в ядрі є екранованими іншими електронами, і центр атома має ефективний позитивний заряд, що дорівнює +1. При певній зміні (заміні Z на Z−1, і використання цілих чисел 1 та 2 для n, що дають чисельне значення Шаблон:Frac для різниці їх обернених квадратів (у формулі, що наведена вище)), формула Рідберґа дає коректні результати у спеціальному випадку K-альфа ліній. Подібні переходи є K-альфа переходом електрона з орбіталі 1s на орбіталь 2p. Це є аналогією переходу ліній Лайман-альфа для водню, і має цей же частотний фактор. Оскільки 2p-електрон не є екранованим від ядра в атомі іншими електронами, то заряд ядра є послабленим єдиним, що залишився 1s-електроном, змушуючи атом бути фактично водневоподібним атомом, але із ослабленим зарядом Z−1. Його частота, таким чином, є частотою Лайман-альфа водню, зростаючи, завдяки величині (Z−1)2. Ця формула f = c/λ = (Лайман-альфа частота)⋅(Z−1)2 історично відома як закон Мозлі (при використанні величини c для заміни у формулі довжини хвилі на частоту), і може бути використана для прогнозування довжин хвиль Kα (K-альфа) рентгенівських променів у спектрах випромінювання хімічних елементів від алюмінію до золота. Історична важливість цього закону можна, оцінити після ознайомлення з біографією Генрі Мозлі. Його закон отримано емпірично приблизно у той же період часу, коли було створено модель атома Бора.
Для інших спектральних переходів у багатоелектронних атомах, формула Рідберґа дає некоректні результати, оскільки величина екранування внутрішніх електронів для переходів зовнішніх електронів варіюється, і неможливо зробити у формулі аналогічну просту величину поправки «компенсування» «ослаблення дії заряду ядра», як вказано вище.