Шаблон:Речовина
Діазометан — це найпростіша діазосполука . Хімічна формула — C H A 2 N A 2
Нітроген у молекулі діазометану заряджений позитивно. Її будову можна зобразити як <mi>C</mi> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mi>H</mi></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mn&gt;2&lt;/mn&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mo stretchy="false"&amp;gt;−&amp;lt;/mo&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;-&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">−</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mi>N</mi></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mo stretchy="false"&gt;+&lt;/mo&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mo stretchy="false"&amp;gt;#&amp;lt;/mo&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mi&amp;amp;gt;N&amp;amp;lt;/mi&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;-&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> C H A 2 = N A + = N A − 2 та N, при чому на групі CH2 негативного заряду трохи більше. Тому кратність зв'язку C-N трохи менша за 3/2, а зв'язку N-N — трохи більша за 5/2.
Молекула має лінійну будову. Довжина зв'язку CN — 134 пм, зв'язку N-N — 113 пм.
За звичайних умов діазометан є жовтим газом. Температура плавлення — -145°С, температура кипіння — -23°С. Ентальпія утворення — 192.5 кДж/моль, ентропія — 242.9 Дж/(моль*К).
Діазометан хімічно дуже активний. Проявляє основні та нуклеофільні властивості, є метилюючим агентом. Може реагувати з речовинами, в яких є рухливий атом гідрогену — водою, кислотами. Для взаємодії зі спиртами потрібен каталізатор :
C H A 2 N A 2 + H X ⟶ C H A 3 X + N A 2
Реакція йде наступним чином: спочатку заряд CH2 дорівнює -1/2, а заряд N2 — +1/2. Протон приєднується до CH2 , утворюючи катіон C H A 3 A 1 / A 2 + N A 2 A 1 / A 2 + азоту , залишаючи CH3 + . В кінці до нього приєднується X- .
Як нуклеофіл, може приєднуватися до альдегідів та кетонів. При взаємодії з формальдегідом утворюється ацетальдегід . При взаємодії з іншими альдегідами утворюються кетони :
H − C O − H + C H A 2 N A 2 ⟶ H A 3 C − C H O + N A 2
<mi>R</mi> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mo stretchy="false">−</mo></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mi&gt;C&lt;/mi&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mi&amp;gt;O&amp;lt;/mi&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mo stretchy="false"&amp;amp;gt;−&amp;amp;lt;/mo&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mtext mathcolor="red"&amp;amp;gt;&amp;amp;amp;lt;mi&amp;amp;amp;gt;H&amp;amp;amp;lt;/mi&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;mtext&amp;amp;gt;-&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">+</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mi>C</mi></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mi&gt;H&lt;/mi&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mn&amp;gt;2&amp;lt;/mn&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mi&amp;amp;gt;N&amp;amp;lt;/mi&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mtext mathcolor="red"&amp;amp;gt;&amp;amp;amp;lt;mn&amp;amp;amp;gt;2&amp;amp;amp;lt;/mn&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;mtext&amp;amp;gt;-&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">−</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mo>&gt;</mo></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mi&gt;R&lt;/mi&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mo stretchy="false"&amp;gt;−&amp;lt;/mo&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mi&amp;amp;gt;C&amp;amp;lt;/mi&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mtext mathcolor="red"&amp;amp;gt;&amp;amp;amp;lt;mi&amp;amp;amp;gt;H&amp;amp;amp;lt;/mi&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;mtext&amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;gt;(&amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;mtext&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mi&amp;amp;amp;amp;amp;gt;O&amp;amp;amp;amp;amp;lt;/mi&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;amp;amp;gt;)&amp;amp;amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;amp;amp;amp;gt;−&amp;amp;amp;amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;amp;amp;gt;-&amp;amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">−</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mi>C</mi></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mi&gt;H&lt;/mi&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mn&amp;gt;2&amp;lt;/mn&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mo stretchy="false"&amp;amp;gt;−&amp;amp;lt;/mo&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mtext mathcolor="red"&amp;amp;gt;&amp;amp;amp;lt;mi&amp;amp;amp;gt;N&amp;amp;amp;lt;/mi&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;mtext&amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;gt;+&amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;mtext&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;amp;gt;#&amp;amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mi&amp;amp;amp;amp;amp;amp;gt;N&amp;amp;amp;amp;amp;amp;lt;/mi&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;amp;gt;-&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">−</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mo>&gt;</mo></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mi&gt;R&lt;/mi&gt;</mtext><mtext>&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mrow data-mjx-texclass="ORD"&gt;&lt;mtext mathcolor="red"&gt;&amp;lt;mo stretchy="false"&amp;gt;−&amp;lt;/mo&amp;gt;&lt;/mtext&gt;&lt;mtext&gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mrow data-mjx-texclass="ORD"&amp;gt;&amp;lt;mtext mathcolor="red"&amp;gt;&amp;amp;lt;mi&amp;amp;gt;C&amp;amp;lt;/mi&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;mtext&amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;gt;&amp;amp;lt;mtext mathcolor="red"&amp;amp;gt;&amp;amp;amp;lt;mi&amp;amp;amp;gt;O&amp;amp;amp;lt;/mi&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;mtext&amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;gt;&amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mo stretchy="false"&amp;amp;amp;amp;gt;−&amp;amp;amp;amp;lt;/mo&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;mtext&amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mi&amp;amp;amp;amp;amp;gt;C&amp;amp;amp;amp;amp;lt;/mi&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mi&amp;amp;amp;amp;amp;amp;gt;H&amp;amp;amp;amp;amp;amp;lt;/mi&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mrow data-mjx-texclass="ORD"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mtext mathcolor="red"&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;amp;lt;mn&amp;amp;amp;amp;amp;amp;amp;gt;3&amp;amp;amp;amp;amp;amp;amp;lt;/mn&amp;amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;mtext&amp;amp;amp;amp;amp;amp;gt;-&amp;amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mtext&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;amp;lt;/mrow&amp;amp;amp;amp;gt;&amp;amp;amp;lt;/mtext&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;amp;lt;/mrow&amp;amp;amp;gt;&amp;amp;lt;/mtext&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;amp;lt;/mrow&amp;amp;gt;&amp;lt;/mtext&amp;gt;&amp;lt;/mrow&amp;gt;&amp;lt;/mrow&amp;gt;&lt;/mtext&gt;&lt;/mrow&gt;&lt;/mrow&gt;</mtext></mrow></mrow></mtext></mrow></mrow> <mo stretchy="false">+</mo> <mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red"><mi>N</mi></mtext><mtext><mrow data-mjx-texclass="ORD"><mrow data-mjx-texclass="ORD"><mtext mathcolor="red">&lt;mn&gt;2&lt;/mn&gt;</mtext><mtext>-</mtext></mrow></mrow></mtext></mrow></mrow>
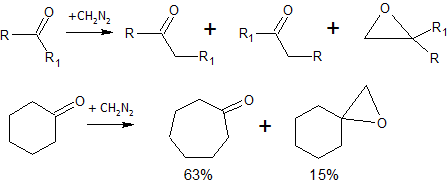
Коли він взаємодіє з кетонами, один з радикалів переходить до CH2 :
При нагріванні розкладається на азот та карбен , який може легко приєднуватись до подвійних зв'язків, утворюючи тричленні цикли:
Взаємодія з етиленом. Взаємодія з бензеном призводить до розширення циклу й утворення циклогептатриєну. При взаємодії з циклічними кетонами також відбувається розширення циклу[ 1]
Вперше діазометан був відкритий Г. Пехманом у 1894 році. Він отримав його при взаємодії гідразину та трихлорметану у лужному середовищі:
N H A 2 − N H A 2 + H C C l A 3 + 3 N a O H ⟶ C H A 2 N A 2 + 3 N a C l + 3 H A 2 O
Найкраще отримувати діазометан зі сполук, що містять замісники з - I-ефектом у α-положені до аміногрупи, наприклад, алкілсечовини, алкілуретанів. З них отримують їх N-нітрозопохідні. Метилсечовину також отримують з метиламіну та Cl-CO-NH2:
H A 3 C − N H A 2 + C l − C O − N H A 2 → O H A − H A 3 C − N H − C O − N H A 2 + H C l
H A 3 C − N H − C O − N H A 2 + H N O A 2 ⟶ H A 3 C − N ( N O ) − C O − N H A 2 + H A 2 O
H A 3 C − N ( N O ) − C O − N H A 2 + 2 N a A + O H A − ⟶ H A 2 C − N A 2 + N a A 2 C O A 3 + N H A 3 + H A 2 O
Замість N-метилсечовини можна також використати метилуретан CH3 -NH-CO-OC2 H5 .
Шаблон:Reflist
Diazomethane | CH2N2 - PubChem Шаблон:Webarchive Диазометан — физико-химические свойства | CHEMBD.NET ICSC 1256
Ластухін Ю. О., Воронов С. А. Органічна хімія . — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6 .
О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1 .