Пірокатехол
Шаблон:Chembox GHS Пірокатехол (пірокатехін, 1,2-бензендіол) — двоатомний фенол з формулою [1]. Ізомер гідрохінону та резорцину.
Отримання
Із саліцилового альдегіду
Пірокатехол можна отримати окисненням саліцилальдегіду пероксидом водню у лужному середовищі[1][2]:
Спочатку альдегід розчиняють у нормальному розчині гідроксиду натрію, далі додають 3% пероксид водню. При цьому суміш нагрівається. Потім розчин стоїть 15-20 годин, а далі додається трохи оцтової кислоти для нейтралізації надлишку лугу. В кінці розчин випарюють на водяній бані[2].
З фенолу
Інший спосіб отримання пірокатехолу - гідроксилювання фенолу пероксидом водню[1]:
Лужним гідролізом
Пірокатехол можна також отримати лужним гідролізом о-хлорофенолу або о-дихлоробензену[1]:
Лужним сплавленням
Ще один спосіб отримання - сплавлення о-фенолсульфокислоти з лугом[1]:
Фізичні властивості
Є безбарвною твердою речовиною з характерним фенольним запахом[3]. При контакті з повітрям на світлі набуває коричневого кольору[4]. Розчинний у воді[3], спирті, діетиловому етері, бензені, хлороформі, ацетоні та піридині[4].
Хімічні властивості
Реакції за участі гідроксильної групи
Кислотні властивості
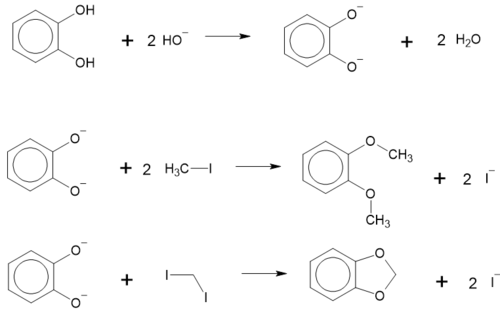
Проявляє кислотні властивості більше, ніж фенол через взаємний вплив двох OH-груп, може утворювати солі з важкими металами. Наприклад, при додаванні до розчину пірокатехолу ацетату свинцю випадає білий осад солі пірокатехолу з свинцем[1][5].
Якісна реакція — поява зеленого забарвлення при додаванні розчину хлориду заліза(III). При додаванні розчину ацетату натрію зелене забарвлення переходить у червоне[5]:
Алкілювання
Алкілюється також легко, з утворенням етерів. При взаємодії з дийодометаном утворює циклічний етер. Ці реакції проходять у лужному середовищі[5]:
При взаємодії з дигалогеноетерами утворюються краун-етери. Наприклад, взаємодія з дихлороетилового етеру призводить до утворення дибензо-[18]-краун-6[6]:
Реакція іде при температурі 100°С у присутності бутанолу. Вихід складає 45%[6].
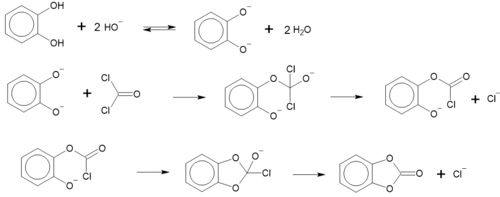
Взаємодія з фосгеном
При взаємодії пірокатехолу з фосгеном відбувається ацилювання і утворюється о-феніленкарбонат, естер пірокатехолу та карбонатної кислоти. Реакція проходить у лужному середовищі[7]:
Спочатку у колбі, яка заповнена азотом, пірокатехол розчиняють у розчині гідроксиду натрію, далі поступово, при перемішуванні, додають розчин фосгену у толуені, при цьому підтрисується температура від 0 до 5°С. Далі розчин ще годину охолоджують і перемішують. Після того, як розчин нагрівся, його фільтрують. Твердий залишок розчиняють у толуені, а потім толуен відганяють, і продукт починає кристалізуватися[7].
Окиснення
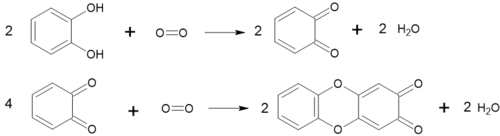
Легко окиснюється до о-бензохінону. Лужні розчини окиснюються ще легше, оскільки при цьому утворюється аніон, який окиснюється легше, ніж сам пірокатехол[1][5][8].
Але серед продуктів окиснення є не тільки бензохінон. Останній може окиснюватися далі з утворенням гетероциклічної сполуки[9]:
При окисненні може і дециклізуватися з утворенням 2-гідрокси-6-оксогекс-2,4-дієнової кислоти[10]:
Завдяки цим властивостям пірокатехол, як і гідрохінон, застосовується як відновник у фотографії[1][5].
Електрофільне заміщення
Реакції електрофільного заміщення, наприклад, галогенування та нітрування, також протікають легше, ніж в одноатомних фенолів[1][5]:
При ацилюванні пірокатехолу фталевим ангідридом утворюється барвник — алізарин:
Поширення
Пірокатехол присутній в деяких рослинах, у деревному димі. Деякі продукти також містять пірокатехол. Ще він міститься у складі вугілля та сигаретного диму, може пересуватися крізь ґрунт[3].
Токсичність
Пірокатехол є токсичною сполукою. Може абсорбуватися через шкіру, викликає дерматит[3]. Спричиняє опіки шкіри та очей[11]. Шкідливий при ковтанні[12]. У великих дозах пошкоджує нирки та печінку[3]. За класифікацією IARC, належить до канцерогенів групи 2B[13].
Також, пірокатехол є токсичним для водних організмів[11].
Примітки
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 1,8 Шаблон:Cite book
- ↑ 2,0 2,1 Шаблон:Cite news
- ↑ 3,0 3,1 3,2 3,3 3,4 Шаблон:Cite web
- ↑ 4,0 4,1 Шаблон:Cite book
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Шаблон:Cite book
- ↑ 6,0 6,1 Шаблон:Cite web
- ↑ 7,0 7,1 Шаблон:Cite news
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ 11,0 11,1 Шаблон:Cite web
- ↑ Шаблон:Cite web
- ↑ Шаблон:Cite web