Хлорангідриди карбонових кислот

Хлорангідриди карбонових кислот (ацилхлориди) — похідні карбонової кислоти, в яких гідроксильна група -OH в карбоксильної групі -COOH замінена на атом хлору. Загальна формула R-COCl. Перший представник з R = H (хлористий форміл) не існує, хоча суміш CO і HCl в реакції Гаттермана—Коха поводиться подібно хлорангидридами мурашиної кислоти.
Номенклатура
Назва хлорангідрид походить від назв відповідних кислотних залишків (ацилів) шляхом додавання до них слова хлористий на початку або слова хлорид в кінці.
Фізичні властивості
Хлорангідриди — це здебільшого рідини, що киплять при значно нижчих температурах, ніж відповідна кислота (через відсутність міжмолекулярних водневих зв'язків). Наприклад, оцтова кислота кипить при 118 °C, в той час як ацетилхлорид — при 51 °C.
В ІЧ-спектрах хлорангідридів міститься, як і у інших карбонільних сполук, інтенсивна смуга поглинання при 1800 см−1.
Отримання
Отримують хлорангідриди найчастіше взаємодією безводної карбонової кислоти з тіонілхлоридом (SOCl2)Шаблон:Sfn, трихлористим фосфором (PCl3)Шаблон:Sfn або п'ятихлористим фосфором (PCl5)Шаблон:Sfn, фосгеном (COCl2)[1].
Ще один метод м'якого отримання хлорангидридов заснований на використанні оксалілхлориду:
Є методи отримання хлорангидридів без виділення хлороводню, наприклад, реакція Аппеля:
або використовуючи ціанурхлорид:[2]
В реакції з тіонілхлоридом утворюються газоподібні діокис сірки і хлороводень, які легко видаляються з реакційної посудини, сприяючи проходженню реакції. Надлишок тіонілхлориду (т.кип. 79 °C) легко видаляється на роторному випарнику. Механізм реакції для тіонілхлориду і пятихлористого фосфору схожі.
Реакція з оксалілхлорид каталізується диметилформамідом. На першій стадії утворюється імінієвий интермедіат:
Імінієва сіль реагує з кислотою, відбираючи кисень, і регенерує диметилформамід.
Хімічні властивості
Нуклеофільні
Наявність кисню і хлору, сильних електроноакцепторів, при одному атомі вуглецю створює великий позитивний заряд на даному атомі, перетворюючи його таким чином в ціль нуклеофільних атак навіть для слабких нуклеофілів. Атом хлору є хорошою групою, що йде, що сприяє нуклефільному заміщенню.
З водою нижчі хлорангидриди реагують надзвичайно енергійно, утворюючи відповідну карбонову кислоту і соляну кислоту:
Менш енергійно відбувається взаємодія зі спиртами:
Аналогічно реагують тіоли:
Реакція з аміаком, первинними і вторинними амінами приводить до відповідних амідів:
Реакцією з солями карбонових кислот отримують ангідриди карбонових кислот:
Також вони реагують з ціанідами:
Застосування розчину лугу, піридину або надлишку аміну в даних реакціях бажано для видалення побічного продукту — хлороводню — і каталізу реакції. Реакція карбонових кислот зі спиртами та амінами оборотна, що призводить до невисоких виходів. У той же час реакція з хлорангидридами швидка і незворотна, а їх синтез досить простий, що робить двостадійний процес кращим.
З вуглецевими нуклеофілами, такими як реактиви Гріньяра, ацилхлориди реагують з високою швидкістю і утворенням кетонів. Використання надлишку реактиву Гріньяра призводить до отримання теоретичних спиртів. У той же час реакція з кадмійорганічними сполуками зупиняється на стадії утворення кетона. Аналогічним чином проходять реакції з реактивом Гілмана (літій диметилмідь (CH3)2CuLi).
В цілому ароматичні ангідриди менш реакційноздатні та вимагають більш жорстких умов проведення реакції, ніж алкільні. Хлорангідриди відновлюються такими сильними відновниками як літій алюміній гідрид або диізобутілалюміній гідрид з утворенням первинних спиртів. Літій три(трет-бутоксі)алюміній гідрид, об'ємистий відновник, відновлює до альдегідів також як і в реакції Розенмунда—Зайцева воднем над «отруєним» паладієвим каталізатором.
Електрофільні
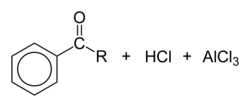
Хлорангідриди карбонових кислот в присутності кислот Льюїса (хлорид заліза(III), хлорид алюмінію) вступають в реакцію Фріделя-Крафтса з ароматичними сполуками, утворюючи ароматичні кетони.
Перша стадія — відщеплення атома хлору кислотою Льюїса:
Далі йде атака ароматичної сполуки карбокатіоном:
Згодом відбувається відщеплення водню з утворенням хлороводню, що звільняється хлорид алюмінію утворює комплекс з ароматичним кетоном по атому кисню
Застосування
Завдяки високій реакційній здатності хлорангидріди широко застосовуються в органічному синтезі як ацилювальні агенти для введення в синтезовану молекулу залишку карбонової кислоти (ацильної групи).
Безпека
Через високу активність ацилхлоридів володіють загальною токсичністю, робота з ними повинна вестися з належною обережністю (захисний одяг, витяжна вентиляція). Ацилхлориди проявляють лакриматорні властивості через гідроліз до хлороводню і карбонової кислоти на слизових оболонках очей і дихальних шляхів.