Метод Гюккеля
Метод Гю́ккеля або молекулярна орбітальна теорія Гюккеля (англ. Hückel molecular orbital theory) — різновид методу МО ЛКАО для визначення енергій π-орбіталей у делокалізованих π-системах (напр. етилен, бензен, бутадієн).[1][2] Метод був уперше запропонований Еріхом Гюккелем у 1930 р. як теоретична основа для правила Гюккеля, а пізніше був розширений для гетероциклічних сполук, таких як піридин, пірол або фуран.[3] Подальше розширення методу Гюккеля, відоме як розширений метод Гюккеля (англ. extended Hückel method, EHM), також бере до уваги σ-електрони. Цей метод був розроблений Роалдом Гоффманом як теоретичний апарат для правил Вудварда–Гоффмана.[4] Щоб запобігти плутанині, класичний метод Гюккеля тепер також називають простим методом Гюккеля (англ. simple Hückel method, SHM).
Незважаючи на свою відносну математичну простоту й обмеженість молекул, до яких він може бути застосований, метод Гюккеля у своєму первісному вигляді є доволі потужним інструментом для аналізу властивостей кон'югованих π-систем. Опис методу Гюккеля можна зустріти в багатьох вступних підручниках з квантової хімії та фізичної органічної хімії; в органічній хімії ця теорія й досі активно застосовується для передбачення результату реакцій, де беруть участь кон'юговані π-зв'язки (наприклад, перициклічних реакцій).
Математична основа методу
Метод Гюккеля використовує роздільність σ-π-електронів: увага приділяється лише π-МО, оскільки саме вони визначають значну частину хімічних і спектральних властивостей молекул. Конструювання π-МО відбувається тільки з -орбіталей, які ортогональні до атомних орбіталей, що утворюють σ-зв'язки, тобто каркас молекули. Наступне припущення полягає в тому, що тільки суміжні -орбіталі задіяні в кон'югації; тобто, подвійні зв'язки, які розділені щонайменш одним атомом, що утворює лише насичені зв'язки, розглядаються як дві окремі π-МО.
Для кон'югованих лінійних полієнів (наприклад, 1,3,5-гексатрієн), енергетичні рівні π-МО задані рівнянням:
,
де
,
,
із числом атомів Карбону в ланцюзі.[5]
Величина — Кулонівський інтеграл. Він відображає енергію зв'язаного електрону в -орбіталі та вважається постійним для всіх -гібридизованих атомів Карбону. Величина — резонансний інтеграл; вона визначає зміну в енергії електрона, делокалізованого між декількома -орбіталями. Значення величин і вираховують за методом Гартрі–Фока.
Для повністю делокалізованих циклічних полієнів застосовується формула:
,
для парного числа атомів Карбону й для непарного.
Лінійні полієни
Знаючи енергії орбіталей, можна сконструювати діаграму МО; ті орбіталі, для яких є зв'язуючими, а орбіталі з є розрихлюючими. Кожна орбіталь має певну кількість вузлових площин: для орбіталі з енергією кількість вузлових площин дорівнює . Вузлові площини завжди проходять через найбільш симетричні точки в МО.
Нижче наведені діаграми МО для етилену, бутадієну й гексатрієну (червоним позначені вузлові площини):[6]

Для π-систем з непарною кількістю атомів Карбону діє такий же принцип, але кількість МО в такому випадку теж буде непарною, а одна орбіталь буде незв'язуючою:[6]

Циклічні полієни: Цикл Фроста
Вид діаграм МО для спряжених циклічних полієнів лежить в основі так званого циклу Фроста-Музуліна (зазвичай використовують назву "цикл Фроста"). Розрахунок енергій МО, як це описано вище, приводить до цікавого спостереження, що циклічні полієни з
атомів Карбону, які мають головну вісь обертання Cn, мають такі енергії МО, що їх можна розмістити у вершинах звичайного
-кутника.[7] Молекули, які мають непарну кількість електронних пар (
π-електронів), повністю заповнюють зв'язуючі й незв'язуючі орбіталі, що є енергетично вигідним. Тому такі сполуки відносяться до ароматичних. При парній кількості електронних пар (
π-електронів) заповнення МО утворює дирадикал, що робить молекулу дуже реактивною, а також є енергетично невигідним. Такі сполуки нестійкі й відносяться до антиароматичних.
- Приклади ароматичних сполук
-
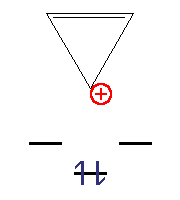
Циклогептатрієніл-катіон (тропілій-катіон)
- Приклади антиароматичних сполук
-
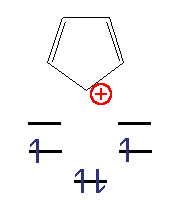
Циклопентадієніл-катіон
-
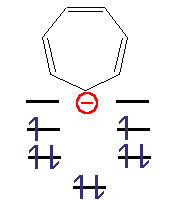
Циклогептатрієніл-аніон
Див. також
Примітки
- ↑ E. Hückel, Zeitschrift für Physik, 70, 204 (1931); 72, 310 (1931); 76, 628 (1932); 83, 632 (1933).
- ↑ Hückel Theory for Organic Chemists, C. A. Coulson, B. O'Leary and R. B. Mallion, Academic Press, 1978.
- ↑ Andrew Streitwieser, Molecular Orbital Theory for Organic Chemists, Wiley, New York (1961).
- ↑ "Stereochemistry of Electrocyclic Reactions", R. B. Woodward, Roald Hoffmann, J. Am. Chem. Soc., 1965; 87(2); 395–397. Шаблон:DOI.
- ↑ Шаблон:Cite book
- ↑ 6,0 6,1 Шаблон:Cite book
- ↑ Шаблон:Cite news