Оксид заліза(III)
Шаблон:Речовина Шаблон:About Окси́д залі́за(III), фе́рум(III) окси́д — неорганічна сполука складу Fe2O3. Проявляє слабкі амфотерні властивості.
Оксид може існувати у трьох структурних модифікаціях — α-, γ-, δ-Fe2O3, які мають різні властивості та різні методи отримання. Модифікації мають світло-коричневий або червоно-коричневий колір. Fe2O3 широко застосовується як пігмент у виготовленні фарб (див. Сангіна), також використовується у виробництві футеровочної кераміки, цементу й магнітних стрічок.
Поширення у природі

Fe2O3 є найбільш стійкою кисневмісною сполукою заліза з тих, що зустрічаються у природі. Даний оксид поширений не лише у вільному стані, а й у складі залізних руд. До їхнього числа належать, зокрема, мінерали магнетит (FeO·Fe2O3), гематит (α-Fe2O3), лимоніт (Fe2O3·H2O) тощо.
Структура
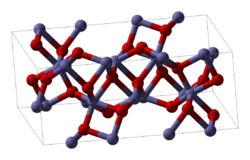
Оксид заліза(III) здатен перебувати у трьох структурних модифікаціях: α-, γ- та δ-формах. Найбільш поширеною з них є α-модифікація — оксид саме цього типу перебуває у природі у вигляді мінералів. Структуру такої модифікації має, наприклад, мінерал гематит. α-Модифікація утворюється при випалюванні заліза (за температури вище 200 °C) або мінералу піриту FeS2, а також при тривалому нагріванні оксиду у γ-формі. α-Fe2O3 є парамагнітним.
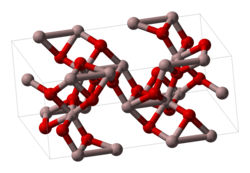
γ-Fe2O3 має структуру типу корунду — мінералу оксиду алюмінію. Дана форма утворюється при низькотемпературному окисненні заліза (нижче 200 °C), при окисненні Fe3O4 або нагріванням α-форми при 300 °C (але за нагрівання вище 400 °C переходить назад у α-форму). γ-Модифікація є феромагнітною.
Модифікація δ-Fe2O3 є феромагнітною та утворюється в розчинах в результаті окиснення сполук Fe(II) лугами.
Отримання
Оксид заліза(III) отримують окисненням заліза, а також деяких його бінарних сполук, наприклад, мінералу піриту:
Іншим способом є термічне розкладання кисневмісних сполук Fe(II) та Fe(III):
- (утворюються домішки SO3)
Також оксид заліза утворюватиметься при нагріванні його галогенідів у струмені водяної пари:
Хімічні властивості
Fe2O3 є стійкою сполукою, він не розчиняється у воді, амоніаку (не утворює комплексні сполуки). При високотемпературному нагріванні він може розкладатися з утворенням змішаного оксиду Fe3O4
Оксид проявляє слабкі амфотерні властивості: розчиняється у кислотах, а також при сплавленні з лугами й іншими осно́вними сполуками утворює ферати:
Fe2O3 відновлюється воднем та оксидом вуглецю CO:
Застосування
Оксид заліза може використовуватися у різних галузях, в залежності від його структури. α-Fe2O3 застосовується для отримання чистого заліза, у виготовленні футеровки, цементу, а також поглинальної маси в очистці газів. γ-Модицікація використовується як складова шару магнітних стрічок.
Деякі природні різновиди Fe2O3 застосовують для виготовлення коричневої олійної фарби під технічними назвами «залізний сурик», «вохра», або «мумія».