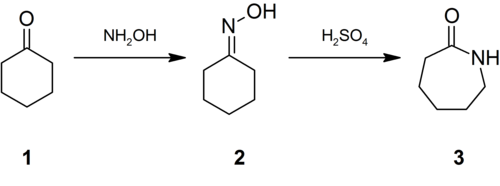Сульфат амонію
Шаблон:Речовина Амо́ній сульфа́т, сульфат амонію — амонієва сіль сульфатної кислоти складу (NH4)2SO4. За звичайних умов є білими, гігроскопічними кристалами.
Основною сферою застосування сульфату амонію є сільське господарство — як азот- та сірковмісне добриво. Також використовується у виробництві персульфатів та антипіренів.
Поширення у природі

У природі сульфат амонію може знаходитися у вигляді мінералу масканьїту. Він кристалізується на вулканічних фумаролах та на джерелах термальних вод.[1]
Фізичні властивості
Сульфат амонію є білими, ортогональними кристалами. Добре розчиняється у воді, не утворюючи гідратів. При 0 °C його розчинність складає 70,6 г на 100 г води та 103,8 г при 100 °C. Не розчиняється в етанолі та ацетоні.
Температура Кюрі 566 °C
Отримання
Сульфат амонію зазвичай синтезується кількома шляхами:
- з аміаку та сульфатної кислоти;
- із коксового газу;
- як побічний продукт органічних синтезів;
- із гіпсу;
- із сульфату міді (домашні або лабораторні умови).
З аміаку та сульфатної кислоти

Даний метод нині є промисловим способом отримання сульфату амонію.
Газуватий аміак впорскується до концентрованої (понад 70 %) сульфатної кислоти і в результаті утворюються кристали солі розміром 0,5—3 мм:
Взаємодія аміаку і кислоти є екзотермічною, але утворене тепло не відводять — воно необхідне для випаровування зайвої води і підтримування стабільно високої концентрації кислоти.
З коксового газу
Масштаби отримання сульфату амонію з коксового газу останніми десятиліттями суттєво зменшуються через модернізацію металургійних підприємств та впровадження безвідходних технологій виробництва.
Коксовий газ, що утворюється в результаті коксування кам'яного вугілля, є сумішшю оксидів вуглецю, водню, метану та, найголовніше, аміаку. Неочищений коксовий газ пропускається крізь сульфатну кислоту з утворенням солі сульфату амонію. Такий продукт має значну кількість домішок у вигляді органічних смол.
Застосовується також непрямий метод: аміак виділяється із водного шару коксівного конденсату під дією вапна і далі пропускається крізь сульфатну кислоту.
Побічний продукт органічних синтезів
Значні кількості сульфату амонію отримують як побічний продукт синтезу капролактаму. Взаємодією циклогексанону з гідроксиламіном синтезують оксим (2), який в олеумі або концентрованій H2SO4 зазнає перегрупування Бекмана із утворенням капролактаму (3).
У реакційній суміші, після охолодження, капролактам перебуває у формі монозаміщеного сульфату. Його витісняють додаванням аміаку, в результаті чого утворюється капролактам та сульфат амонію як побічний продукт.
З гіпсу
Через дефіцит сульфатної кислоти у часи Першої світової війни, науковцями BASF був розроблений метод отримання сульфату амонію з гіпсу. Дрібно помелений гіпс змішують із розчином карбонату амонію:
Взаємодію проводять протягом кількох годин у резервуарах із перемішуванням, а потім фільтрують на вакуум-фільтрах. Карбонат кальцію добре виділяється із суміші завдяки його малій розчинності.
Також можна проводити взаємодію шляхом пропускання газуватих аміаку та оксиду вуглецю крізь суспензії гіпсу:
З купрум сульфату
Утворюється в розчині при осадженні гідроксиду міді(II) (світло-блакитний осад) з розчину сульфату міді (мідного купоросу) аміаком або його водним розчином (нашатирним спиртом) на відкритому повітрі чи під витяжкою:
Розчин треба помішувати до зникнення інтенсивного темно-синього забарвлення аміачного комплексного іона міді [Cu(NH3)4]2+, який утворюється при надлишку аміаку, а аміак додавати до повного осадження міді.
Хімічні властивості
При нагрівання на повітрі сульфат амонію починає розкладатися при температурі понад 100 °C, а у вакуумі — при 513 °C.
При вищих температурах, більше 300 °C, можуть також виділятися незначні кількості N2, SO2, SO3, H2O.
У розчинах сполука добре дисоціює із частковим гідролізом, утворюючи кисле середовище:
При взаємодії твердого (NH4)2SO4 з концентрованою сульфатною кислотою утворюється монозаміщений сульфат:
Сульфат амонію вступає в реакції обміну з лугами та деякими солями:
При нагріванні окиснюється сильними окисниками до вільного азоту:
При електролізі розчину солі в концентрованій сульфатній кислоті, утворюється персульфат амонію:
- (на платиновому або платинованому аноді утворюється персульфат, а на катоді — водень).
Застосування

Практично увесь синтезований сульфат амонію застосовується як добриво. Окрім значного вмісту в сполуці азоту, в ній також присутня важлива для аграріїв сірка.
У менших масштабах сіль використовується для виробництва персульфатів, антипіренів. Також застосовується у фотографії, текстильній та скляній промисловостях.